El mieloma múltiple es una enfermedad de la sangre que se origina en las células plasmáticas de la médula ósea. Según los datos de la Sociedad Española de Oncología Médica, en España se diagnostican cada año alrededor de 3.000 casos, con un pronóstico muy variable. Generalmente, los pacientes controlan la enfermedad y no tendrán un riesgo vital a corto o medio plazo. Sin embargo, a largo plazo es más incierto debido al riesgo de recaída que existe.
En este artículo hablaremos de cómo es la convivencia con el mieloma múltiple: la cronificación de la enfermedad, las recaídas y las recomendaciones para afrontar los efectos secundarios de los tratamientos y secuelas.
Cronificación de la enfermedad y riesgo de recaída
El mieloma múltiple se considera una enfermedad incurable, ya que la mayoría de los pacientes sufrirán recaídas después del tratamiento inicial. A pesar de esto, muchos de ellos tienen una buena respuesta al tratamiento inicial en las primeras semanas y tendrán un mejor pronóstico. En los extremos están los pacientes que tendrán una respuesta excelente y quizás no recaerán nunca (pacientes funcionalmente curados) y los pacientes que pueden ser resistentes al tratamiento inicial o que recaen muy pronto.
Los tratamientos disponibles para el mieloma múltiple son varios, pero su principal objetivo es frenar la evolución de la enfermedad y reducir los síntomas; es decir, cronificar la enfermedad. Con los avances en investigación y el desarrollo de nuevos fármacos, los pacientes tienen periodos de remisión cada vez más largos, y pueden vivir con calidad de vida gracias a la cronificación de la enfermedad.
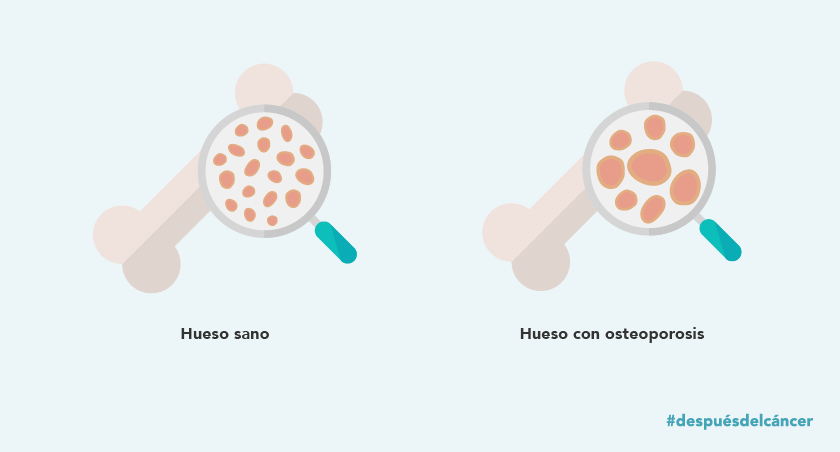
El riesgo de recaída de los pacientes también es variable. La frecuencia y agresividad de estas afectan al pronóstico de cada persona. Además, los pacientes de mieloma múltiple pueden tener un riesgo aumentado de leucemia mieloide aguda y síndrome mielodisplásico. Como en otros casos, seguir un estilo de vida saludable teniendo en cuenta la dieta y la práctica de ejercicio pueden tener un efecto positivo en este riesgo.
Convivencia con el mieloma múltiple y recomendaciones para gestionar la enfermedad
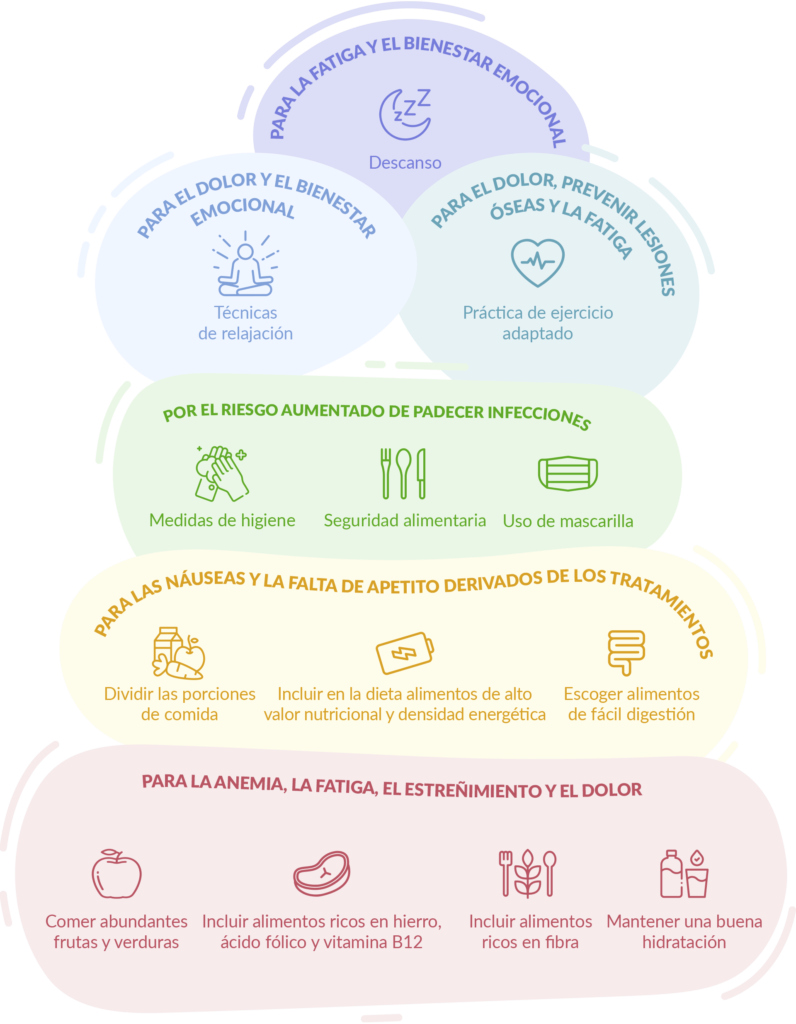
Para convivir con la enfermedad, hay una serie de recomendaciones relacionadas con los síntomas de la enfermedad, los posibles efectos secundarios de los tratamientos y las secuelas (dolor, infecciones, fatiga, lesiones óseas…) que pueden ser útiles. Las puedes encontrar con más detalle en la guía completa de recomendaciones para pacientes y cuidadores sobre mieloma múltiple de la Fundación Josep Carreras, pero te las resumimos a continuación:
- Seguir una dieta a base de frutas y verduras, rica en nutrientes como el hierro (carnes rojas, legumbres, espinacas…), el ácido fólico y la vitamina B12 (pescado, huevos, lácteos UTH…), pueden ayudar a reducir la anemia, la fatiga y el dolor. Además, incluir alimentos ricos en fibra (semillas de lino o salvado, cítricos, kiwis o ciruelas) y una buena hidratación son fundamentales para combatir el estreñimiento.
- Dividir las porciones de comida a lo largo del día, escoger alimentos de fácil digestión, con alto valor nutricional y de alta densidad energética, evitar los alimentos azucarados o preparar cremas enriquecidas pueden ayudar a gestionar la falta de hambre durante el tratamiento. Además, evitar alimentos calientes, muy pesados y con olor fuerte y masticar bien, puede ayudar a reducir las náuseas.
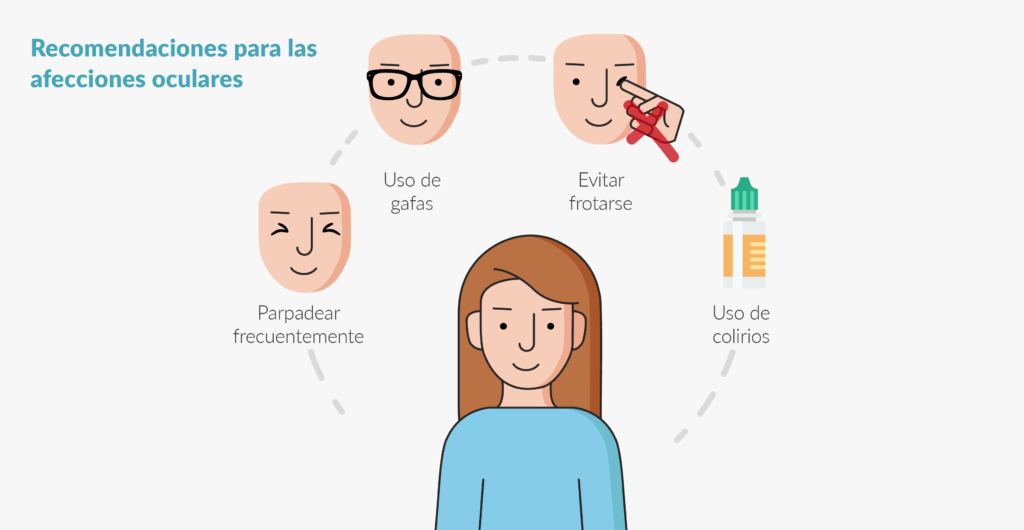
- Extremar la higiene (especialmente de las manos), tener una buena higiene bucodental, hacer uso de mascarilla en ambientes concurridos de gente, mantener buenas prácticas de seguridad alimentaria y conservación de los alimentos y beber mucha agua, son prácticas recomendables debido al riesgo aumentado de sufrir infecciones.
- La práctica de ejercicio es conveniente para afrontar el dolor, prevenir lesiones óseas y combatir la fatiga. En todo caso, el ejercicio se tiene que adaptar a cada persona y situación, pero puedes encontrar más información al respecto en nuestro artículo sobre los beneficios de la actividad física después del mieloma múltiple.
- Las técnicas de relajación son un buen aliado para reducir los nervios y la ansiedad, y así contribuir también a reducir el dolor neuropático.
- Finalmente, un buen descanso es fundamental para el bienestar, especialmente para reducir la fatiga y mejorar el estado de ánimo en general. Es importante cuidar las horas de sueño y la calidad de este creando un buen ambiente de descanso.
En cuanto a la gestión emocional, una de las principales dificultades a las que se enfrentan los pacientes de mieloma múltiple es la convivencia con la incertidumbre. A pesar de que los tratamientos han mejorado en los últimos años y los pacientes pueden vivir largos periodos de remisión de la enfermedad, el miedo a las recaídas está muy presente en la vida de los pacientes. Por eso, tener un buen apoyo psicológico es clave.
Algunas de las recomendaciones que pueden ayudar a manejar este miedo es la preparación de las consultas médicas, puesto que la comunicación con el equipo médico es clave para establecer una relación de confianza y colaboración. Hacer una lista de dudas y posibles preguntas no solo del momento actual, sino también pensando en el seguimiento y desde el punto de vista del cuidador puede ser de ayuda para tratar de resolver las dudas que puedan surgir.
Además, planificar actividades de ocio y rutinas, practicar técnicas como el mindfulness, realizar actividades que ayuden a focalizar la atención y requieren concentración, leer, practicar ejercicio y, sobre todo, pedir ayuda si se necesita, no solo a la gente del alrededor sino también a asociaciones especializadas en la enfermedad y otros profesionales.
En definitiva, a pesar de que el mieloma múltiple todavía no tiene cura definitiva, los avances permiten a los pacientes, en muchos casos, vivir con la enfermedad cronificada. Junto con las recomendaciones para hacer frente a los síntomas y efectos de los tratamientos, así como el cuidado de la salud mental, vivir con mieloma durante años es posible disfrutando de una buena calidad de vida.
CONVIVIR CON EL MIELOMA MÚLTIPLE
Recomendaciones generales para tener una mejor calidad de vida
Referencias
- El mieloma múltiple
- Vivir con mieloma múltiple
- Vida después del diagnóstico de mieloma múltiple
- Cánceres posteriores al mieloma múltiple
- Convivir el mieloma múltiple
- Guía para pacientes y familiares. Convivir con el mieloma múltiple
- Guía práctica sobre mieloma múltiple per a pacientes i cuidadores