El mieloma múltiple és una malaltia de la sang, que s’origina a les cèl·lules plasmàtiques de la medul·la òssia. Segons les dades de la Societat Espanyola d’Oncologia Mèdica, a Espanya es diagnostiquen cada any al voltant de 3.000 casos, amb un pronòstic molt variable. Generalment, els pacients controlen la malaltia i no tindran un risc vital a curt o mitjà termini. No obstant això, a llarg termini és més incert pel risc de recaiguda que existeix.
En aquest article parlarem de com és la convivència amb el mieloma múltiple: la cronificació de la malaltia, les recaigudes i les recomanacions per afrontar els efectes secundaris dels tractaments i seqüeles.
Cronificació de la malaltia i risc de recaiguda
El mieloma múltiple es considera una malaltia incurable, ja que la majoria de pacients patiran recaigudes després del tractament inicial. Malgrat això, molts d’ells tenen una bona resposta al tractament inicial en les primeres setmanes i tindran un millor pronòstic. En els extrems estan els pacients que tindran una resposta excel·lent i potser no recauran mai (pacients funcionalment curats) i els pacients que poden ser resistents al tractament inicial o que recaiguin molt aviat.
Els tractaments disponibles pel mieloma múltiple són diversos, però el seu principal objectiu és frenar l’evolució de la malaltia i reduir els símptomes, és a dir, cronificar-la. Amb els avanços en investigació i el desenvolupament de nous fàrmacs, cada vegada els pacients tenen períodes de remissió més llargs i poden viure amb qualitat de vida amb la malaltia cronificada.
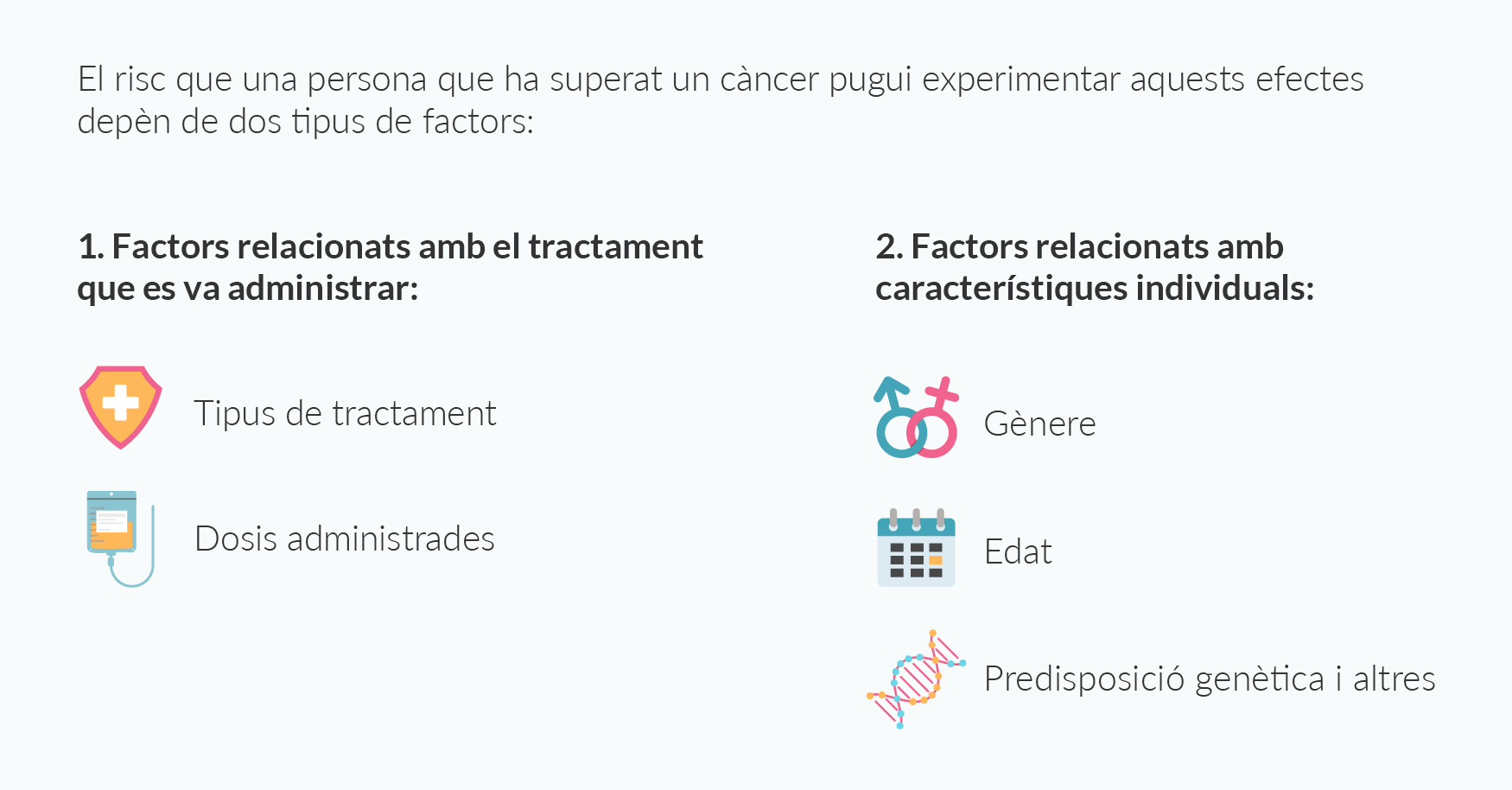
El risc de recaiguda dels pacients també és variable. La freqüència i agressivitat d’aquestes afecten al pronòstic de cada persona. A més, els pacients de mieloma múltiple poden tindre un risc augmentat de leucèmia mieloide aguda i síndrome mielodisplàsic. Com en altres casos, seguir un estil de vida saludable tenint en compte la dieta i la pràctica d’exercici poden tenir un efecte positiu en aquest risc.
Convivència amb el mieloma múltiple i recomanacions per gestionar la malaltia
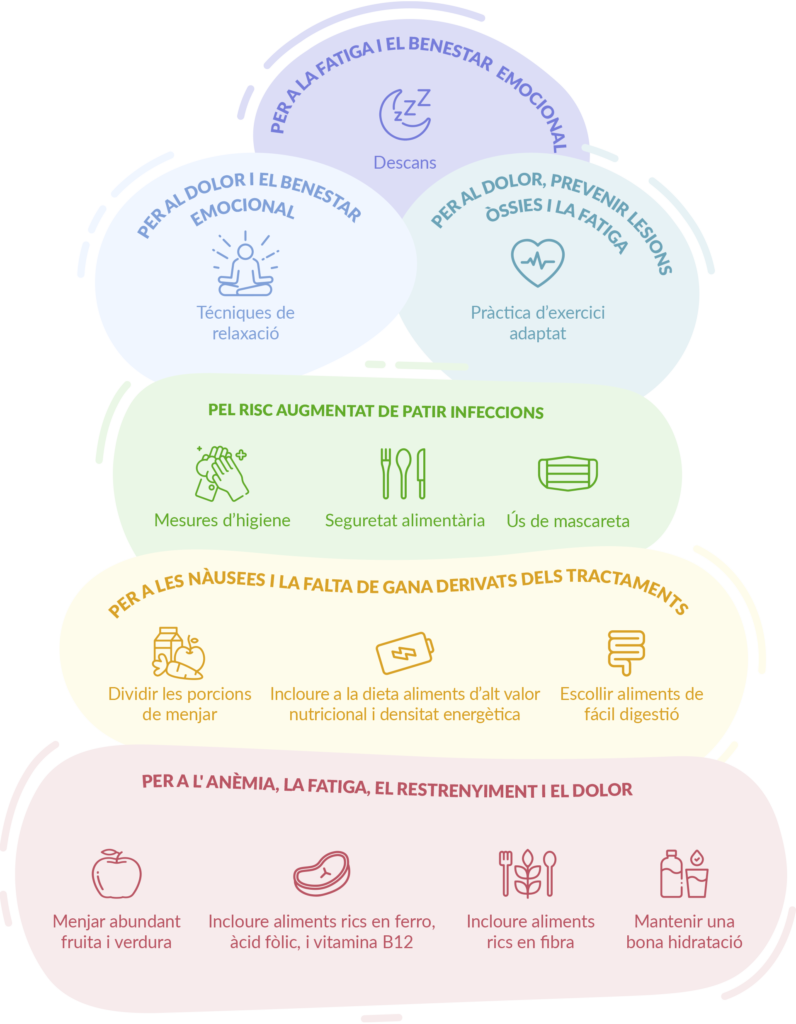
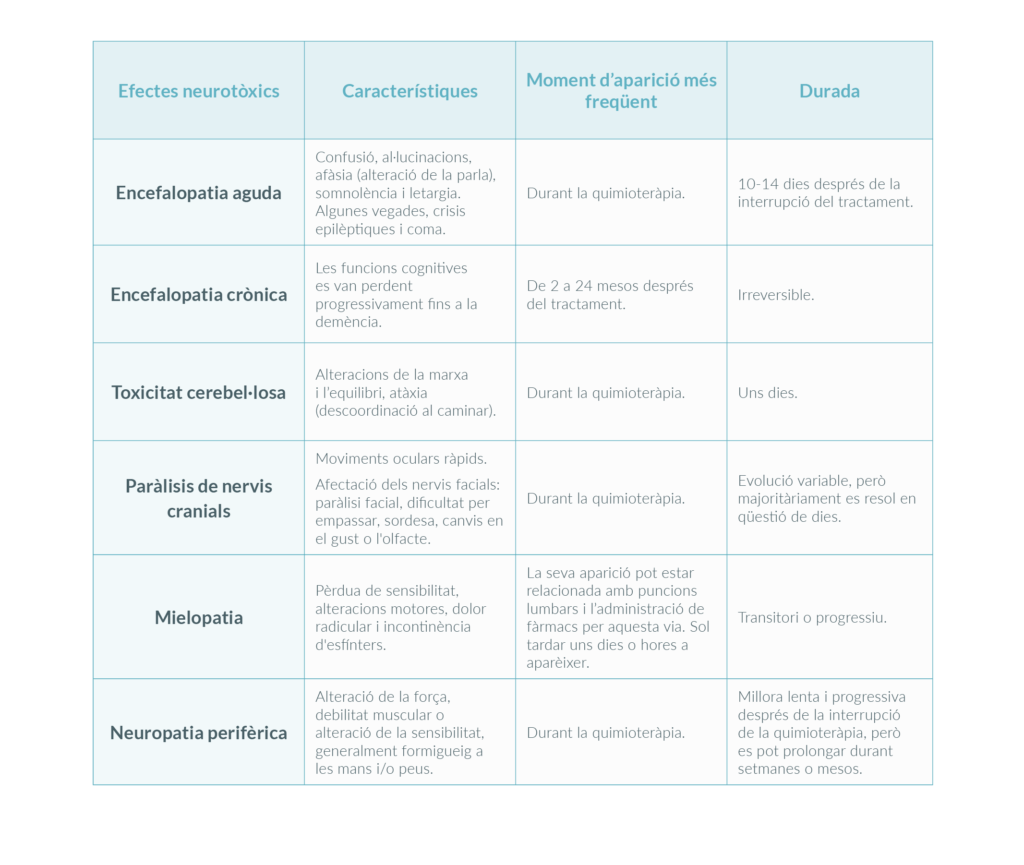
Per tal de conviure amb la malaltia, hi ha una sèrie de recomanacions relacionades amb els símptomes de la malaltia, possibles efectes secundaris dels tractaments i seqüeles (dolor, infeccions, fatiga, lesions òssies…) que poden ser útils. Les pots trobar amb més detall a la guia completa de recomanacions per a pacients i cuidadors sobre mieloma múltiple de la Fundació Josep Carreras, però te les resumim a continuació:
- Seguir una dieta a base de fruites i verdures, rica en nutrients com el ferro (carns roges, llegums, ..), l’àcid fòlic i la vitamina B12 (peix, ous, lactis UTH…), poden ajudar a reduir l’anèmia, la fatiga i el dolor. A més a més, incloure aliments rics en fibra (llavors de lli o segó, cítrics, kiwis o prunes) i una bona hidratació són fonamentals per combatre el restrenyiment.
- Dividir les porcions de menjar al llarg del dia, escollir aliments de fàcil digestió, amb alt valor nutricional i d’alta densitat energètica, evitar els aliments ensucrats o preparar cremes enriquides poden ajudar a fer front a la falta de gana durant el A més, evitar aliments calents, molt pesats i amb olor forta i mastegar bé, pot ajudar a reduir les nàusees.
- Extremar la higiene (especialment de les mans), tindre una bona higiene bucodental, fer ús de mascareta en ambients concorreguts de gent, mantenir bones pràctiques de seguretat alimentària i conservació dels aliments i beure molta aigua, són pràctiques recomanables degut al risc augmentat de patir
- La pràctica d’exercici és convenient per fer front al dolor, prevenir lesions òssies i combatre la fatiga. En tot cas, l’exercici s’ha d’adaptar a cada persona i situació, però pots trobar més informació al respecte al nostre article sobre els beneficis de l’activitat física després del mieloma múltiple.
- Les tècniques de relaxació són un bon aliat per reduir els nervis i l’ansietat, i així contribuir també a reduir el dolor neuropàtic.
- Finalment, un bon descans és fonamental per al benestar, especialment pel que fa a reduir la fatiga i millorar l’estat d’ànim en És important cuidar les hores de son i la qualitat d’aquest creant un bon ambient de descans.
Pel que fa a la gestió emocional, una de les principals dificultats a què s’enfronten els pacients de mieloma múltiple és la convivència amb la incertesa. Tot i que els tractaments han millorat en els últims anys i els pacients poden viure llargs períodes de remissió de la malaltia, la por a les recaigudes està molt present a la vida dels pacients. Per això, tenir un bon suport psicològic és clau.
Algunes de les recomanacions que poden ajudar a fer front a aquesta por és la preparació de les consultes mèdiques, ja que la comunicació amb l’equip mèdic és clau per establir una relació de confiança i col·laboració. Fer una llista de dubtes i possibles preguntes no només del moment actual, sinó també pensant en el seguiment i des del punt de vista del cuidador pot ser d’ajuda per tractar de resoldre els dubtes que puguin sorgir.
A més a més, planificar activitats d’oci i rutines, practicar tècniques com el mindfulness, proposar-se activitats que ajudin a focalitzar l’atenció i requereixen concentració, llegir, practicar exercici i, sobretot, demanar ajuda si es necessita, no només a la gent del voltant sinó també d’associacions especialitzades en la malaltia i altres professionals.
En definitiva, tot i que el mieloma múltiple encara no té cura definitiva, els avanços permeten als pacients en molts casos, viure amb la malaltia cronificada. Juntament amb les recomanacions per tal de fer front als símptomes i efectes dels tractaments, així com la cura de la salut mental, viure amb mieloma durant anys és possible gaudint d’una bona qualitat de vida.
CONVIURE AMB EL MIELOMA MÚLTIPLE
Recomanacions generals per a tenir una millor qualitat de vida