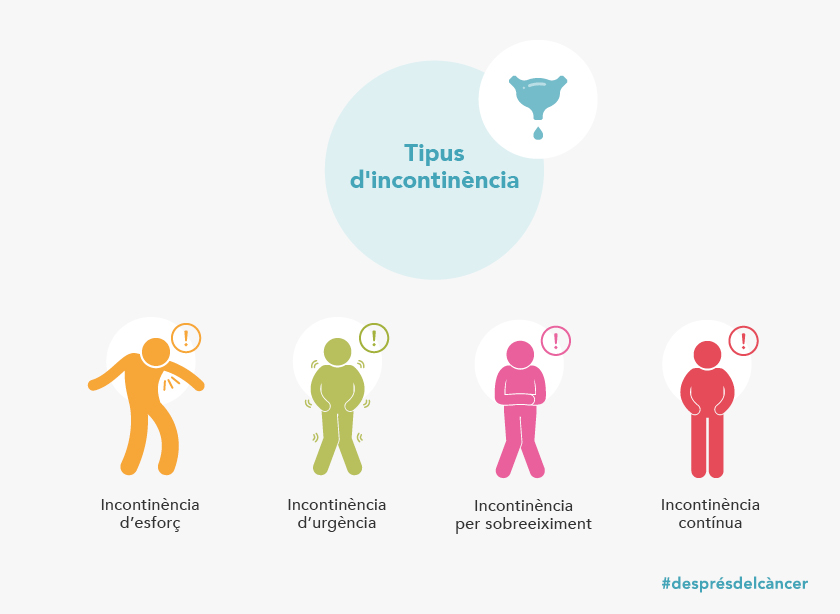
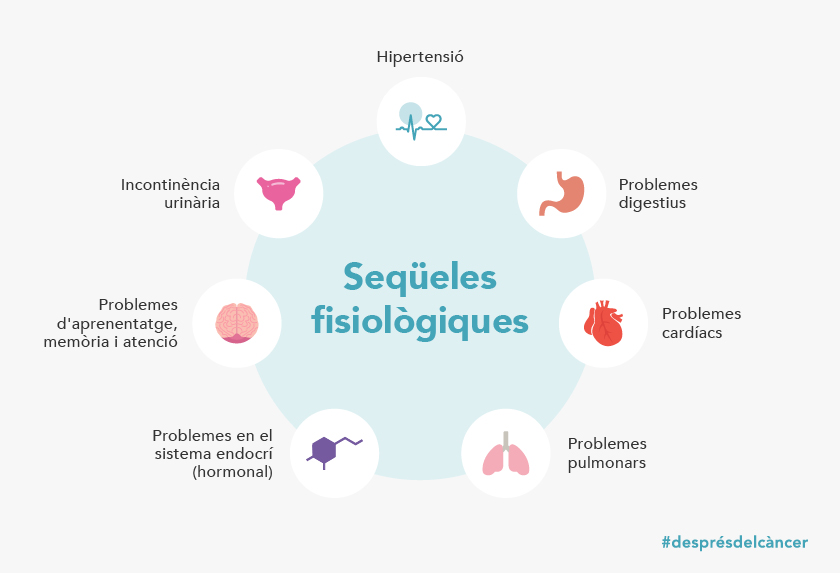
Als últims anys, la supervivència del càncer de pulmó ha augmentat notablement. Per aquesta raó, actualment existeix més evidència que fa uns anys de possibles seqüeles del tractament tant a curt com a llarg termini.
Encara que no ha de descartar-se l’aparició de seqüeles tardanes després del tractament, la probabilitat que aquestes apareguin una cop superat el càncer de pulmó són baixes. Un exemple són les seqüeles després de la radioteràpia, on la probabilitat que un efecte secundari a llarg termini aparegui és de menys d’un 5%.
En aquest cas concret, s’ha pogut observar que la radioteràpia en càncer de pulmó (que es realitza a la zona toràcica) pot estar relacionada amb l’aparició d’algunes seqüeles determinades al cor i als pulmons, encara que aquestes no sempre tenen per què aparèixer.
Seqüeles al pulmó
La radiació en la zona pulmonar pot ocasionar efectes a curt i a llarg termini. A curt termini (menys de 6 mesos després de l’inici de la radioteràpia), la seqüela més comuna és la pneumonitis. Els símptomes que poden aparèixer són tos, dificultat respiratòria i febre baixa.
La principal seqüela a llarg termini és la fibrosi pulmonar, encara que la probabilitat de patir-la és molt baixa. Aquesta pot derivar-se de la inflamació típica de la pneumonitis, que causaria la fibrosi del teixit pulmonar. El mecanisme és el mateix que en un procés de cicatrització, però en aquest cas sense cap teixit que reparar. Els símptomes típics són tos seca no productiva, dolor en el pit, ofec o dificultat i fatiga.
Seqüeles al cor
Els efectes secundaris al cor han estat molt descrits en altres tipus de càncers, com el de mama, el d’esòfag, els limfomes de Hodgkin o els càncers en nens. No obstant això, en càncer de pulmó encara no hi ha disponible tanta evidència, per la qual cosa són necessaris més estudis que complementin la informació existent en l’actualitat.
La informació publicada fins a aquest moment documenta l’existència d’aquests problemes cardíacs tardans, encara que fan falta més estudis per a relacionar-los directament amb la radioteràpia, com sí s’ha comprovat en altres càncers que també irradien la zona toràcica.
Una revisió dels estudis publicats fins avui sobre el tema revela que moltes de les seqüeles cardíaques es van manifestar 2 anys després del tractament. Alguns dels problemes cardíacs que s’han observat en persones que han rebut radioteràpia per càncer de pulmó són els següents:
– Infarts supraventriculars i miocàrdics.
– Pericarditis: El pericardi és una doble membrana fibrosa que embolica el cor, protegint-lo dels òrgans que té al voltant. A la pericarditis, la membrana s’inflama i irrita. Això causa dolor agut al pit i deficiència cardíaca, perquè el cor ha de treballar més per a bombar. La gravetat d’aquesta afecció depèn del grau d’inflamació que es tingui.
– Vessament pericardíac: Es dóna quan hi ha una acumulació excessiva de líquid dins del pericardi. El líquid pot remetre de manera espontània, però també pot ser que s’hagi d’extreure de manera quirúrgica.
D’altra banda, s’han de tenir en compte determinats factors de risc, com la dosi de radiació al cor, l’historial de problemes cardíacs, si la persona és o ha estat fumadora, la lateralitat de tumor o la modalitat de tractament (s’ha vist que hi ha més risc cardíac si s’ha combinat la radioteràpia amb quimioteràpia).
Com es prevenen i es tracten aquestes seqüeles?
El més important a l’hora de tractar aquestes seqüeles, així com per a prevenir-les, són uns hàbits de vida saludable. Les persones que han superat un càncer de pulmó tenen el risc de sofrir algun d’aquests efectes tardans, però no vol dir que els vagin a tenir. Mantenir uns bons hàbits, tant abans del càncer com durant i després, minimitzarà aquest risc. Per tant, portar una dieta equilibrada, fer exercici regular (especialment cardiovascular) o no fumar, per exemple, són punts essencials.
En cas de considerar-ho necessari, el metge podria recomanar un tractament adequat per a aquestes seqüeles. En el cas de la fibrosi pulmonar, per exemple, es recomana, en primer lloc, portar un estil de vida saludable i vacunar-se contra determinats microorganismes per a la prevenció d’algunes infeccions en les vies respiratòries.
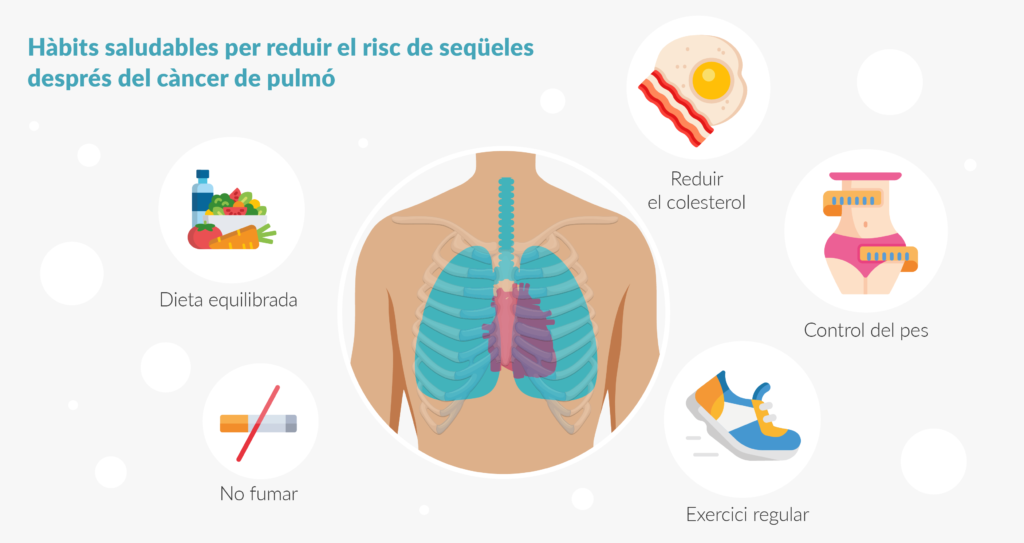
En resum, amb els avanços a la teràpia de càncer de pulmó s’ha descrit l’aparició de possibles seqüeles després del tractament una vegada superat el càncer, però les probabilitats que aquestes apareguin són molt baixes . Així i tot, portar uns hàbits de vida saludable és la millor opció per a ajudar a prevenir la seva aparició.
Referències
Cancer.net. Efectos secundarios de la radioterapia.
American Cancer Society. La vida después del tratamiento de cáncer de pulmón microcítico.
MayoClinic. Prednisona y otros corticoesteroides.
Huang Y, Zhang W, Yu F, Gao F. The Cellular and Molecular Mechanism of Radiation-Induced Lung Injury. Med Sd Monit. 2017;23:3446-3450.
Ming X, Feng Y, Yang C et al. Radiation-induced heart disease in lung cancer radiotherapy: A dosimetric Update. Medicine. 2016; 95:41.
Simone CB. Thoracic Radiation Normal Tissue Injury. Semin Radiat Oncol. 2017;27:370-377.
Giridhar P, Mallick S, Kishore-Rath G et al. Radiation Induced Lung Injury: Prediction, Assessement and Management. Asian Pac J Cancer Prev. 2015; 16(7):2613-2617.
Montero A, Hervás A, Morera R et al. Control de síntomas crónicos. Efectos secundarios del tratamiento con Radioterapia y Quimioterapia. Oncología. 2015; 28(3):147-156.
Grupo Español de Pacientes con Cáncer. Todo lo que empieza cuando “termina” el cáncer.